※ 文章中の長い数式はスクロールできます!
※ 著作権の都合上、問題全文は掲載できません。 問題はお手持ちのもので参照してください。
2019年大阪医科大学第3問
| 問1 | E アセチルサリチル酸 F サリチル酸メチル G ノボラック H レゾール |
B 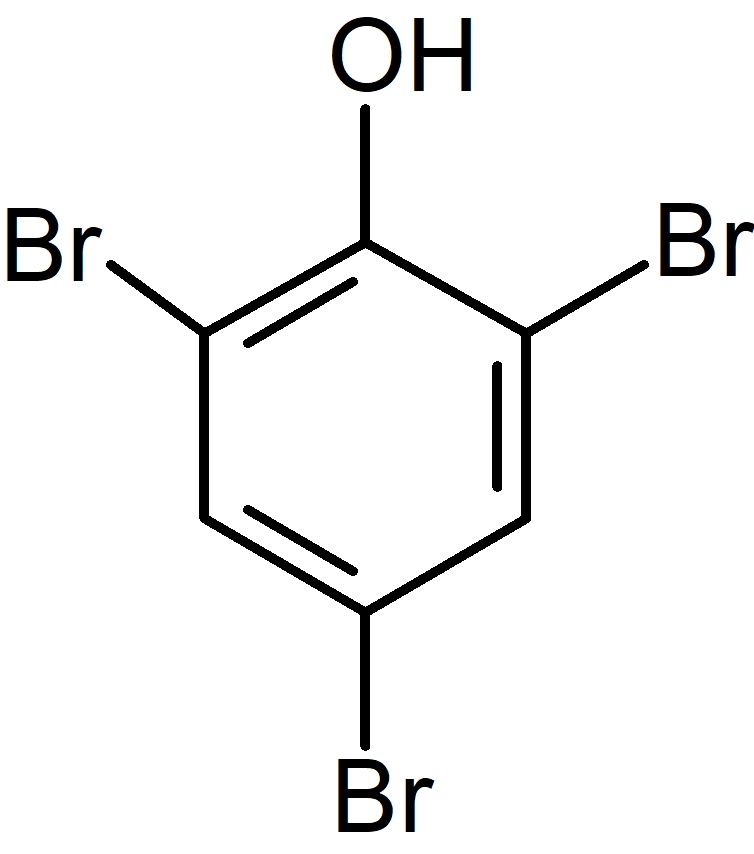 | |
| 問2 | ア ① 酸 ② 酸 ③ 塩基 |
| 問3 | $\ce{CH3COCH3 + 3I2 + 4NaOH -> CH3COONa + CHI3 + 3H2O + 3NaI}$ |
| 問4 | $11$ % |
| 問5 | $\pu{62 L}$ |
問1・問2
フェノール ・・・ 水に少し溶けて酸性を示す。
クメン法 ・・・ フェノール + アセトン
下線部の反応は, 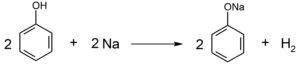 (☆)
(☆)
フェノールは臭素付加を受けるが,オルト,パラ配向性により B の構造をとる。
フェノールからフェノール樹脂を作る方法は 2 通りある。
① フェノールとホルムアルデヒドに酸触媒を加えて加熱するとノボラックができる。これに硬化剤などを加えて適切な条件で反応させるとフェノール樹脂が生成する。
② フェノールとホルムアルデヒドに塩基触媒を加えて加熱すると、レゾールができる。さらに加熱すると(硬化剤を加えなくても、)フェノール樹脂が生成する。
問3
ヨードホルム反応はイチから作ると時間がかかるので、覚える方が良い。
ケト型
$\ce{CH3COR + 3I2 + 4NaOH -> CHI3 + RCOONa + 3H2O +3NaI}$
係数が3433
アルコール型
$\ce{CH3CH(OH)R + 4I2 + 6NaOH -> CHI3 + RCOONa + 5H2O +5NaI}$
係数が4655
本問はアセトンなのでケト型の R=$\ce{CH3}$ で答えれば良い。
問4
ベンゼン($\pu{78 g/mol}$) $\pu{1 mol}$ から、フェノール ($\pu{94 g/mol}$)が $\pu{1 mol}$ 生成する。
生成するフェノールの理論量を$x$ [g] とおくと、
$\begin{align}
\dfrac{200}{78} &= \dfrac{x}{94} \\
\\
x &= \dfrac{94 \times 200}{78}\\
\end{align}$
$ \begin{align}
\therefore \text{(収率)} &= \dfrac{27}{\dfrac{94 \times 200}{78}} \times 100 \\
\\
&=\dfrac{27 \times 78}{94 \times 200} \times 100\\
\\
&= 11.2 \cdots
\end{align}$
よって $11$%
問5
問1・2の ☆ 式より $\ce{H2}$ は $\dfrac{470}{94} \times \dfrac{1}{2}$ (mol) 生成するので、
$\begin{align}
V = \dfrac{nRT}{P} &= \dfrac{(\dfrac{470}{94} \times \dfrac{1}{2}) \times \pu{8.3E3} \times 300}{\pu{1000E2}}\\
\\
&= 62.25 \fallingdotseq \pu{62 L}
\end{align}$



