- 「錯イオン」とは普通のイオンとは何が違うのか?
- 錯イオンの名称や形の一覧を手っ取り早く見たい!
- $\ce{[Ag(NH3)2]+}$ という式をどのようにして作るのか?名称の作り方は?
この記事では上記の要望にできるだけ応えられるように、錯イオンの説明や一覧、式の作り方などについて書いています。
高校化学全体の勉強法やおすすめの参考書はコチラから読めます!
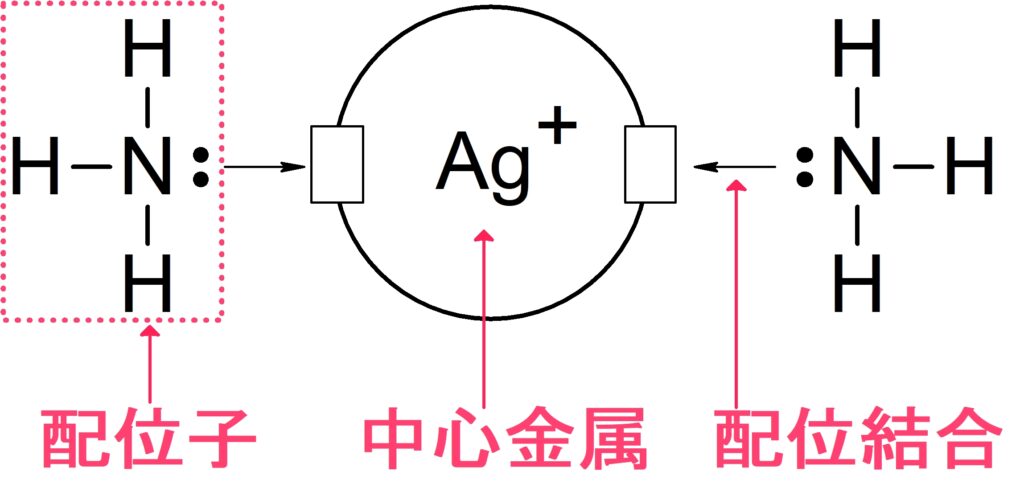
錯イオンとは金属元素と非金属元素が配位結合したイオン
高校化学においては,金属元素と非金属の原子が配位結合によって結合した化合物がイオンとなっているものを指します。
このとき非金属の原子をもつ分子やイオンを配位子といい,金属と結合する配位子の個数を配位数とよびます。
代表的な錯イオンの一覧 ~化学式と名称と形と色~
大学入試では最頻出
| 化学式 | 名称 | 形 | 色 |
| $\ce{[Ag(NH3)2]+}$ | ジアンミン銀 (I) イオン | 直線形 | 無色 |
| $\ce{[Cu(NH3)4]^{2+}}$ | テトラアンミン銅 (II) イオン | 正方形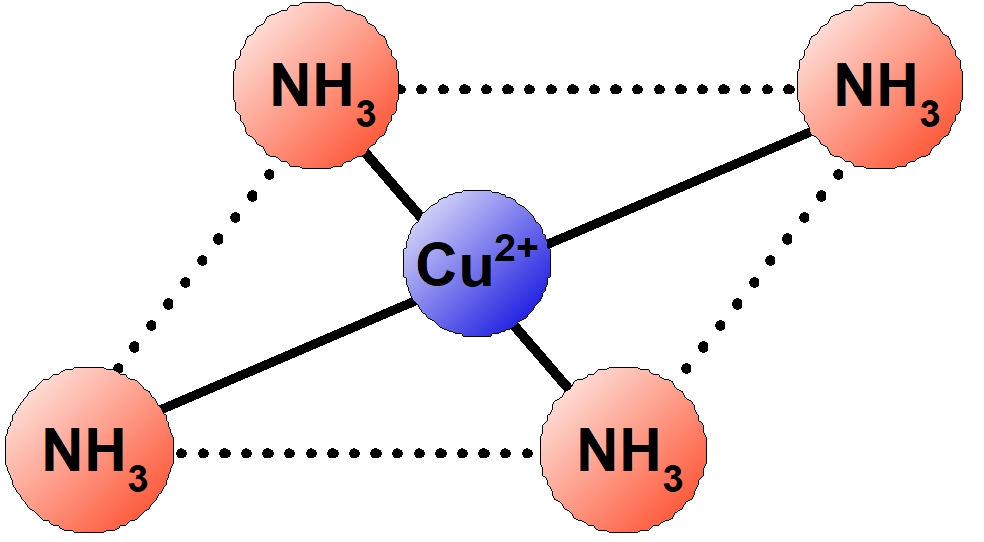 | 深青色 |
| $\ce{[Zn(NH3)4]^{2+}}$ | テトラアンミン亜鉛 (II) イオン | 正四面体形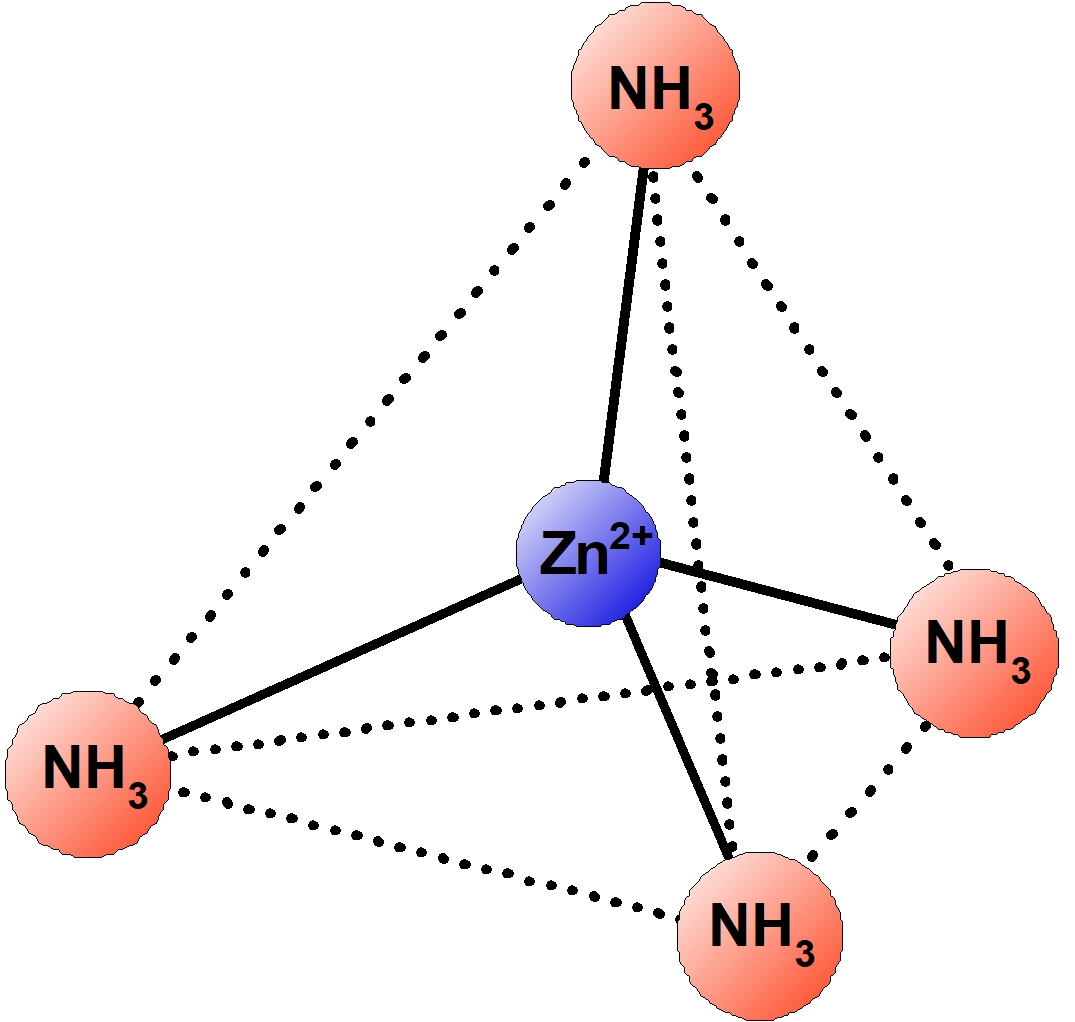 | 無色 |
| $\ce{[Fe(CN)6]^3-}$ | ヘキサシアニド鉄 (III) 酸イオン | 正八面体形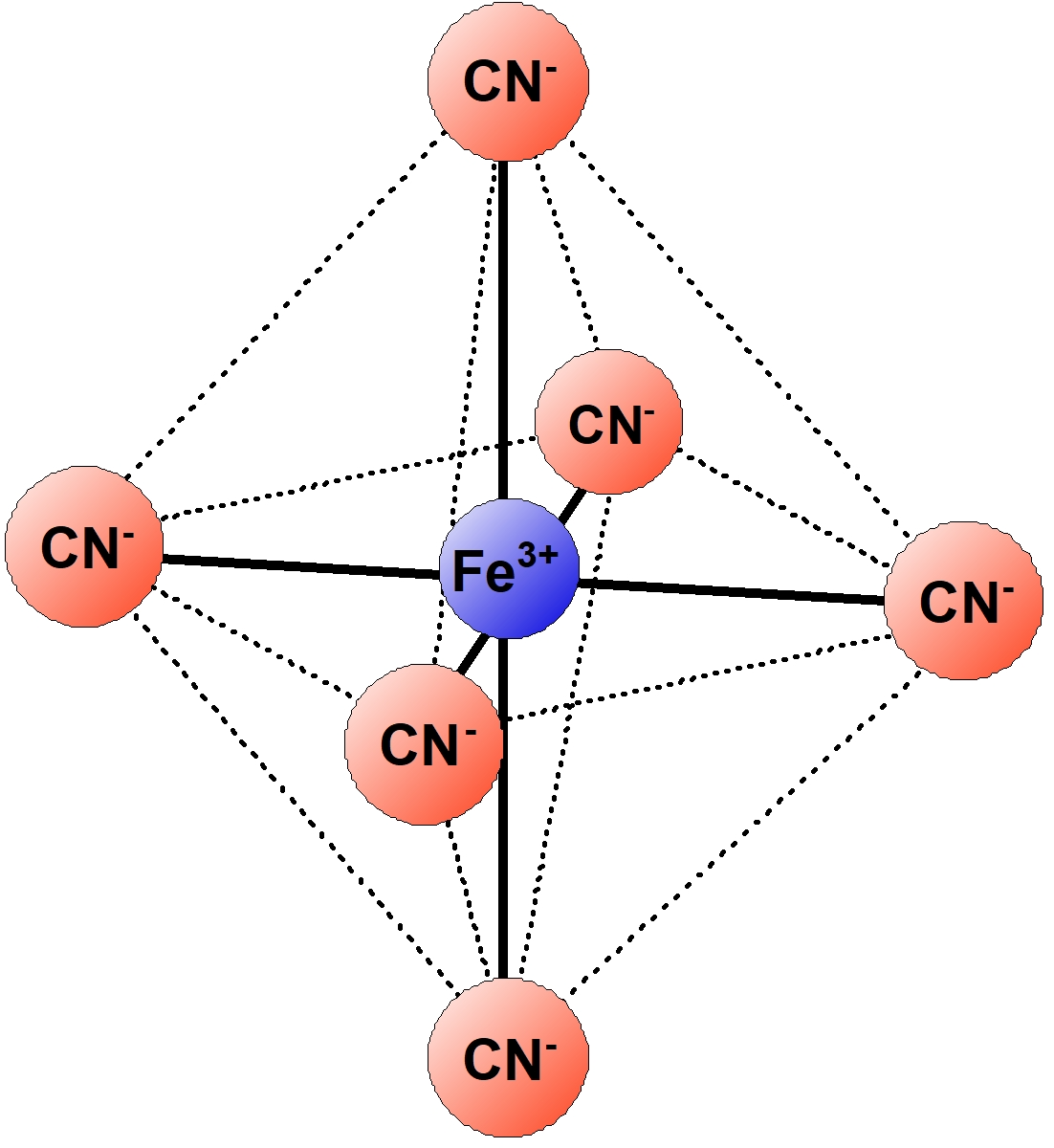 | 黄色 |
| $\ce{[Al(OH)4]-}$ | テトラヒドロキシドアルミン酸イオン | 八面体形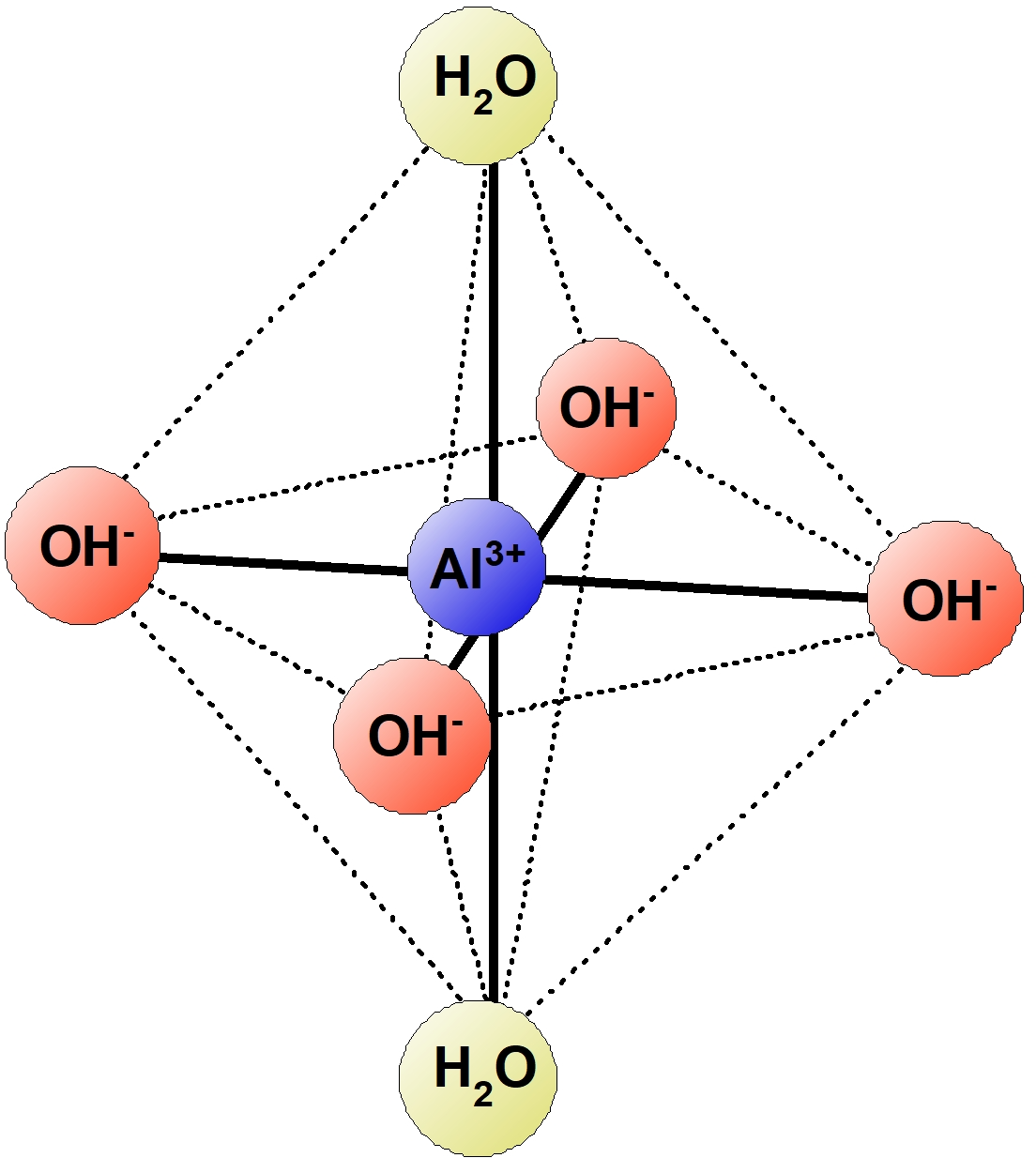 | 無色 |
配位子としての $\ce{H2O}$ は式で書くときに省略している。
大学入試で頻出ではないが登場する錯イオン
表中の ※ の内容(斜体で表記)は暗記しなくてもOKです。
| 化学式 | 名称 | 形 | 色 |
| $\ce{[Ag(S2O3)2]^3-}$ | ビス(チオスルファト)銀 (I) 酸イオン ※ | 直線形 | 無色 ※ |
| $\ce{[Cu(H2O)4]^2+}$ | テトラアクア銅 (II) イオン | 正方形 | 青色 |
| $\ce{[Co(NH3)6]^3+}$ | ヘキサアンミンコバルト (III) イオン | 正八面体 | 橙色 or 淡赤色 ※ |
錯イオンのイオン式の作り方
錯塩や錯イオンのイオン式を作れるようになるには,次の手順で勉強をしていけば良いです。
種類は多いが,金属のイオンの価数を $2$ 倍すれば良いものが多いので楽できる。
有機化学でもでてくるものなので頑張って覚えよう。
なお,錯イオンが絡んだ化学反応式の作り方はコチラからどうぞ。
中心金属と配位数の関係
目安として,その金属のイオンの価数の $2$ 倍の数値が配位数となります。
| 中心金属 | 配位数 |
| $\ce{Ag+}$ | 2 |
| $\ce{Cu^2+}$ | 4 |
| $\ce{Zn^2+}$ | 4 |
| $\ce{Fe^2+}$ | 6 ※1 |
| $\ce{Fe^3+}$ | 6 |
| $\ce{Al^3+}$ | 6 ※2 |
| $\ce{Co^3+}$ | 6 |
※1 イオンの価数の $2$ 倍ではないことに注意。
※2 イオンの価数の $2$ 倍であるが注意が必要。例えば,強塩基性水溶液中では配位子 $\ce{OH-}$ が $4$ つ,$\ce{H2O}$ が $2$ つ配位している$\ce{[Al(OH)4 (H2O)2]^-}$ の構造をとる。そして配位子としての $\ce{H2O}$ は省略するため $\ce{[Al(OH)4]^-}$ と表記する。 $\ce{Al}$ は $6$ 配位であるが見た目が $4$ 配位に見えてしまうので注意。
配位子とその名称
| 配位子の化学式 | 名称 |
| $\ce{NH3}$ | アンミン |
| $\ce{OH^-}$ | ヒドロキシド |
| $\ce{CN^-}$ | シア二ド |
| $\ce{H2O}$ | アクア |
| $\ce{Cl-}$ | クロリド |
数詞
| 数 | 読み方 |
| $1$ | モノ |
| $2$ | ジ |
| $3$ | トリ |
| $4$ | テトラ |
| $5$ | ペンタ |
| $6$ | ヘキサ |
実際に式をつくって名前をつける
上の 3 つの表の中身が暗記・理解できていれば,イオン式を作ることができます。
銀イオンがアンモニアと結合して錯イオンを生成した。そのときの錯イオンの化学式と名称を記せ。
銀の配位数は $2$, イオンの価数は $+1$, アンモニアはイオンではなく分子なのでイオンの価数は $0$ 。このことから,錯イオン全体のイオンの価数は,$(+1)+ 0 \times 2 = +1 $
よって錯イオンの化学式は,$$\ce{[Ag(NH3)2]+}$$ と分かります。
名称は以下のように名付けていけばOKです。
数詞 → 配位子 → 中心金属 → その金属の価数 → (錯イオンが陰イオンなら)「酸」→ 「イオン」
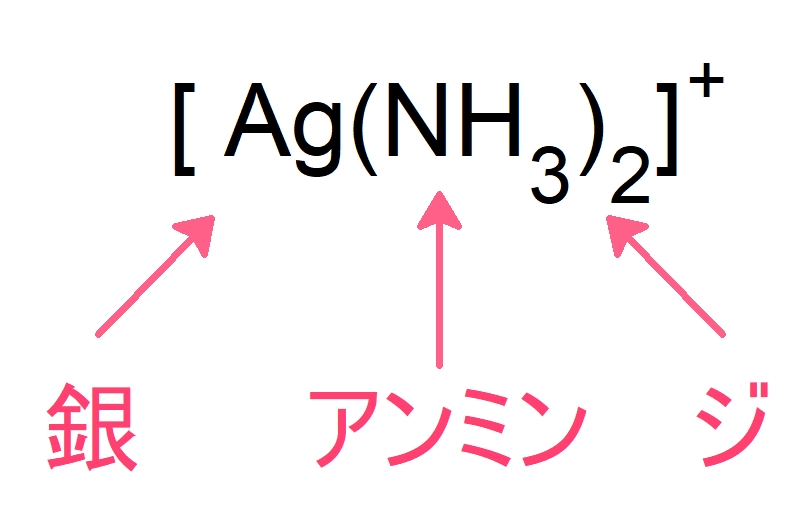
よってこの錯イオンの名称は,
ジアンミン銀 (I) イオン
と分かります。
鉄(II)イオンがシアン化物イオン $\ce{CN-}$と結合して錯イオンを生成した。そのときの錯イオンの化学式と名称を記せ。
鉄(II)イオンの配位数は $6$, イオンの価数は鉄 (II) とあることから $+2$, シアン化物イオンの価数は $-1$ 。このことから,錯イオン全体のイオンの価数は,$(+2) + (-1) \times 6 = -4 $
よって錯イオンの化学式は,$$\ce{[Fe(CN)6]^{4-}}$$ と分かります。名称は下の図を参照。

この錯イオンの名称は,
ヘキサシアニド鉄(II)酸イオン
と分かります。
高校化学における名称の例外
$\ce{[Al(OH)4]-}$ の名称は,「テトラヒドロキシドアルミニウム (III) 酸イオン」ではなく「テトラヒドロキシドアルミン酸イオン」です。この「アルミン酸」が慣用名であるため暗記するしかありません。金属の価数 (III) も不要です。



