化学の問題を紹介します。
(10) 物質の構成
(10-001) 周期表において原子番号1番から36番まで周期表の形で書けるようにせよ。
答えと解説
(答)下の表を参照。
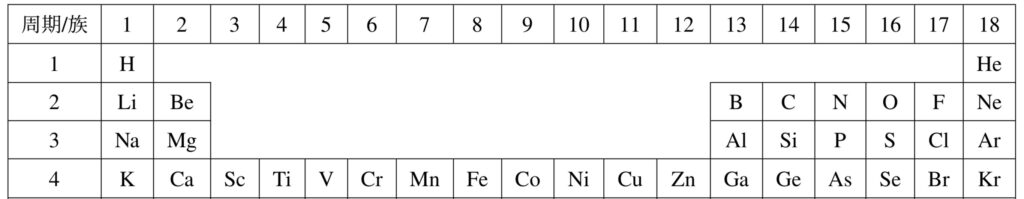
(解説)次の語呂合わせが有名。
水兵リーベ僕の船。
(H, He, Li, Be, B, C, N, O, F, Ne)
七曲がりシップス、クラークか。
(Na, Ma, Al, Si, P, S, Cl, Ar, K, Ca)
ここまでで20個。ゴロ自体の意味は特に考えずに乗り切るべし。
閣下(かっか)スコッチ暴露マン。
(K, Ca, Sc, Ti, V, Cr, Mn)
K と Ca は上と被っている(クラークか、の部分)ので注意。
鉄子にどう会えんが、ゲッ斡旋(あっせん)ブローカー。
(Fe, Co, Ni, Cu, Zn, Ga, Ge, As, Se, Br, Kr)
以上36個。元素名は以下を参照。元素記号の左下にある数字は原子番号である。
| $\ce{_1H}$ | 水素 | $\ce{_19K}$ | カリウム |
| $\ce{_2He}$ | ヘリウム | $\ce{_20Ca}$ | カルシウム |
| $\ce{_3Li}$ | リチウム | $\ce{_21Sc}$ | スカンジウム |
| $\ce{_4Be}$ | ベリリウム | $\ce{_22Ti}$ | チタン |
| $\ce{_5B}$ | ホウ素 | $\ce{_23V}$ | バナジウム |
| $\ce{_6C}$ | 炭素 | $\ce{_24Cr}$ | クロム |
| $\ce{_7N}$ | 窒素 | $\ce{_25Mn}$ | マンガン |
| $\ce{_8O}$ | 酸素 | $\ce{_26Fe}$ | 鉄 |
| $\ce{_9F}$ | フッ素 | $\ce{_27Co}$ | コバルト |
| $\ce{_10Ne}$ | ネオン | $\ce{_28Ni}$ | ニッケル |
| $\ce{_11Na}$ | ナトリウム | $\ce{_29Cu}$ | 銅 |
| $\ce{_12Mg}$ | マグネシウム | $\ce{_30Zn}$ | 亜鉛 |
| $\ce{_13Al}$ | アルミニウム | $\ce{_31Ga}$ | ガリウム |
| $\ce{_14Si}$ | ケイ素 | $\ce{_32Ge}$ | ゲルマニウム |
| $\ce{_15P}$ | リン | $\ce{_33As}$ | ヒ素 |
| $\ce{_16S}$ | 硫黄 | $\ce{_34Se}$ | セレン |
| $\ce{_17Cl}$ | 塩素 | $\ce{_35Br}$ | 臭素 |
| $\ce{_18Ar}$ | アルゴン | $\ce{_36Kr}$ | クリプトン |
(10-002) 乾燥空気は混合物である。空気を構成する純物質を、その体積組成が高い順番に4つ答えよ。
答えと解説
(答)窒素、酸素、アルゴン、二酸化炭素
(解説)アルゴンと二酸化炭素の順番に注意。
窒素 78.1%, 酸素 20.9 %, アルゴン0.9%, 二酸化炭素 0.04% である。
(10-003) 次の物質のうち、混合物を全て選べ。
二酸化炭素 塩酸 石油
硫酸銅(II)五水和物 エタノール
答えと解説
(答)塩酸 石油
(解説)混合物は、何種類かの物質が様々な割合で混ざり合ったもの。
二酸化炭素は、$\ce{CO2}$ の粒子のみで存在するので純物質。(元素記号が2種類なので化合物。)
塩酸は、塩化水素 $\ce{HCl}$ と水が様々な割合で混ざったものなので混合物。
石油は、軽油や灯油、ナフサなどの様々な液体が混ざっている混合物。
硫酸銅(II)五水和物は、$\ce{CuSO4.5H2O}$ のみで存在するので純物質。
$\ce{CuSO4}$と$\ce{H2O}$は $1:5$ の決まった割合で結合しているので混合物ではない。
エタノールは、$\ce{C2H5OH}$ の粒子のみで存在するので純物質。
(10-004) 塩化ナトリウム水溶液に砂が混ざっている。実験室で砂のみを分離するのに最も適切な操作を次から1つ選べ。
蒸留 分留 ろ過 再結晶 昇華
答えと解説
(答)ろ過
(解説)液体と、その液体に溶けていない物質をろ紙を用いて分離させる操作を、ろ過という。砂はろ紙の目を通らない。塩化ナトリウムの言葉だけを見て蒸留を選ばないように。
(10-005) 塩化ナトリウム水溶液から水のみを分離させるのに最も適切な操作を次から1つ選べ。
蒸留 分留 ろ過 再結晶 昇華
答えと解説
(答)蒸留
(解説)液体と、その液体に溶けている不揮発性の物質を、沸点の差で分離する方法を蒸留という。塩化ナトリウムと水の沸点はそれぞれ1400℃と100℃なので、水溶液を加熱することで水のみが気体になれる。これをリービッヒ冷却器を用いて冷やせば純粋な水が得られる。
分留は、液体どうしの混合物を沸点の差を利用して分ける操作である。例えば「石油を分留操作で分離する」という言い方ができる。
(10-006) 硝酸カリウムに少量の塩化ナトリウムが混ざった固体がある。この固体から塩化ナトリウムのみを分離したい。このときにおこなう最も適切な分離操作を答えよ。
答えと解説
(答)再結晶
(解説)温度による水への溶解度の差を利用した固体物質の精製法を再結晶という。
硝酸カリウムと少量の塩化ナトリウムからなる混合物を一旦、高温の水に溶かす。塩化ナトリウムは冷やしても水への溶けやすさはほぼ変わらないが、硝酸カリウムは冷やすと水にほとんど溶けなくなっていく。よってこの高温の水を冷やしていくと、硝酸カリウムの結晶(固体)だけが生成してくる。すなわち、塩化ナトリウムを分離できたことになる。
この硝酸カリウムと塩化ナトリウムの組み合わせは、再結晶では鉄板の組み合わせなので覚えておいてほしい。
(10-007) 植物の葉から、緑色の成分のみをとり出したい。このときにおこなう最も適切な分離操作を答えよ。
答えと解説
(答)抽出
(解説)混合物に含まれる特定の成分だけをよく溶かす液体を加えて振り混ぜ、その特定の成分を溶かし出す分離方法を抽出という。
植物の葉をすり鉢ですりつぶす。これにエタノールを十分加えてさらに潰していくとエタノールに緑色の成分が溶け込む。これをろ過すれば、固体(葉)が除かれ、緑色の成分が得られる。
(10-008) 砂が混じった固体のヨウ素から、ヨウ素のみをとり出したい。このときにおこなう最も適切な分離操作を答えよ。
答えと解説
(答)昇華法
(解説)昇華(固体から直接気体になること)と凝華(気体から直接固体になること)の性質を利用して、昇華しやすい物質のみ分離する方法を昇華法という。
問題の混合物(固体)をビーカーに入れ、三脚にのせた金網にのせる。ビーカーを丸底フラスコで蓋をし、丸底フラスコの中に氷水を入れる。ビーカーをガスバーナーを用いて加熱すると、ヨウ素のみが昇華して気体になる丸底フラスコ付近の気体のヨウ素が凝華して固体となり、丸底フラスコの底部の表面に付着する。しばらくして、丸底フラスコを引き上げれば、固体のヨウ素のみが得られる。
(10-009) この分離法に利用される「ろ紙」を用いて、サインペンのインクに含まれる色素を分離した。この分離操作を何というか。
答えと解説
(答) ペーパークロマトグラフィー もしくは クロマトグラフィー
(解説)
ろ紙にサインペンで印をつけ、ろ紙の一端を水(展開液)に浸すと、紙につけたインクが水と一緒に上に移動する。インクに含まれる異なる色素は速度が異なるため、それぞれが異なる距離まで移動する。結果として、元の混合物の色素が分かれて異なる場所に現れることで、どの色素が混合物に含まれているかを識別できる。
クロマトグラフィーは成分を分離する方法のひとつで、その中にペーパークロマトグラフィーが含まれる。他にも液体クロマトグラフィーや薄層クロマトグラフィーなどがあるが、大学受験においてはペーパークロマトグラフィーを理解しておけば十分である。
(10-010) 蒸留の実験において加熱されて出てきた気体を液体にするために用いる、ドイツの化学者の名前がついた実験器具の名称を答えよ。
また、この器具で冷却水を流す方向は、「上から下」または「下から上」のどちらか。
答えと解説
(答) リービッヒ冷却器 下から上
(解説)冷却器の中を水で満たすために、下から上へ流す。上から下に流すと、重力に従ってただ通過するだけとなり、冷却効率が格段に落ちる。(引用動画の1:17あたり)
また熱交換の観点から、「蒸気の移動方向と冷却水の移動方向」が逆の関係であるほど、熱交換の効率が良いことも分かっている。以上の理由から、冷却水は「下から上」に流す方が良い。
(10-011) 塩化ナトリウムの水溶液から水を取り出す蒸留の実験において、温度計を取り付ける位置はどこが良いか。最も適切な選択肢を次から一つ選べ。
(A)枝付きフラスコの枝の部分
(B)水溶液の液面付近
(C)水溶液の内部
答えと解説
(答)(A)枝付きフラスコの枝の部分
(解説)この水溶液から水を取り出すには、水と塩化ナトリウムの沸点の差を利用して水を水蒸気とすれば良い。水は 100℃ で沸騰するので、蒸気の温度が 100℃ であるかを確かめる必要がある。もし 100℃ に達していないにも関わらず、リービッヒ冷却器を通して液体が出てきているのであれば、それは水ではないものが混ざっている可能性がある。(例えばフラスコの洗浄が不十分で、内部に付着した何かが出てきたのかもしれない。)水蒸気のみであれば、純物質であることから 100 ℃で一定になっている必要がある。(混合物であれば沸点は一定とならない。)
以上から、枝に入ってくる蒸気の温度を確認することが重要なので、選択肢の中では(A)が適切である。
(10-012)蒸留の際に溶液に入れる「沸騰石」は、なぜ必要なのか。10字程度で答えよ。
答えと解説
(答)
・突然の沸騰を防ぐため。(11字)
・突沸を防ぐため。(8字)
(解説)液体を加熱する際、沸点以上の温度になっても沸騰せず、ある刺激がきっかけで突然沸騰することがある。これを突沸(とっぷつ)という。
突沸を防ぐには、沸騰石や細管を入れることで気泡を液中に生成させて、これをきっかけとしてスムーズに溶液を沸騰させることができる。
沸騰石には細かい孔(あな)があり、そこに空気が入り込んでいる。沸騰石を溶液に入れると気泡が出てきて孔には液体が入り込むため、一度用いた沸騰石は再利用できない。したがって毎回新しい沸騰石を用いるようにする。
(10-013)同じ元素からなる単体で、性質が異なる物質どうしのことを、漢字 3 字で何というか。漢字で答えよ。
答えと解説
(答)同素体
(解説)同素体とは、同じ元素からなる単体で、性質が異なる物質どうしのことである。例えば、炭素「$\ce{C}$」の単体には、ダイヤモンド・黒鉛・フラーレンといった性質の異なる物質が存在する。ダイヤモンドは宝石、黒鉛は鉛筆の芯で思い浮かべれば、性質が違うということが分かるだろう。
高校化学では「$\boldsymbol{\ce{S, C, O, P}}$」(スコップの語呂で覚える。)のそれぞれの同素体を覚える必要がある。
なお、$\ce{CO, CO2}$は同じ元素で性質が異なる物質どうしであるが、単体でなく化合物であるから、同素体の関係ではない。
(10-014) 酸素の同素体の名称を2つ答えよ。
答えと解説
(答)酸素・オゾン
(解説)酸素 $\ce{O2}$ と、オゾン $\ce{O3}$ である。
元素名としての「酸素」と単体の名前としての「酸素」が同じなので、不安になるかもしれない。問題文の「酸素」は元素名で、答えの「酸素」は単体の名前である。(同素体は定義から「単体」の物質である。)
(10-015) 硫黄の同素体の名称を 3 つ答えよ。
答えと解説
(答)斜方硫黄・単斜硫黄・ゴム状硫黄
(解説)斜方硫黄がこの3つの中では常温で最も安定であること、斜方硫黄と単斜硫黄の分子式が $\ce{S8}$ であることは覚えておきたい。
最初は覚えづらいだろうから、単斜→斜方、のように「しりとり」っぽく唱えて覚えると良い。ゴム状は気合い。
覚えられたら、斜方硫黄が最も安定なので、斜方から言えるようにすると完璧。
(10-016) リンの同素体の名称を 2 つ答えよ。
答えと解説
(答)赤リン・黄リン
(解説)赤リンは空気中で安定に存在し、毒性は少ない。化学式は組成式で $\ce{P}$ と書かれることがある。マッチの側薬に含まれる。
黄リンは空気中で自然発火するので水中に保存する。毒性は極めて高い。化学式は分子式で$\ce{P4}$
赤の方が危険であれよ、と思うよね。(個人的感想)
黄リンの方が危険性が高いイメージを持っておく。
黄リンについて。受験には無関係。受験生は見なくても良い。
書籍やネットで調べると分かるように、実は黄リンは、白リンに不純物として少量の赤リンが含まれている混合物である。同素体はその定義から単体であるので、黄リンは同素体ではない。しかし現段階で高校化学の学習内容においては、古い情報である「黄リン」がリンの同素体として扱われているので、受験勉強をする上では「黄リンは同素体」として覚えることになる。先生もそれを承知の上で授業されるだろうから、上からの物言いで指摘しないように。釈迦に説法である。
(10-017) 次の元素の炎色反応の色を、語群から選び1つ答えよ。
① $\ce{Cu}$ ② $\ce{Ca}$ ③ $\ce{Na}$
語群
赤 黄 紫 橙赤 黄緑 青緑 紅
答えと解説
(答)① 青緑 ② 橙赤 ③ 黄
成分元素を含む水溶液を白金線につけてガスバーナーの外炎に入れると、元素に特有の色の炎となる。これを炎色反応という。
語呂合わせ
リアカー 無き K村 の 加藤 さんは 馬力(ばりき)で 努力 するべえ。
で覚えると良い。
$\ce{Li}$ 赤 (リアカー)
$\ce{Na}$ 黄 (無き)
$\ce{K}$ 紫 (K村)
$\ce{Ca}$ 橙赤 (加藤)
$\ce{Ba}$ 黄緑 (馬力)
$\ce{Cu}$ 青緑 (ど(う)りょく)
$\ce{Sr}$ 紅 (するべ(え))
(10-018) グルコースに酸化銅(II)を混ぜて燃焼させると気体が発生した。この気体を石灰水に通すと白濁した。また、加熱した際に生じた液体を硫酸銅(II)の白色粉末に触れさせると青色に変色した。この実験結果から、グルコースに含まれる元素を2つ推測し、名称で答えよ。
答えと解説
(答)炭素と水素
(解説)石灰水を白濁したので、気体は二酸化炭素 $\ce{CO2}$ と分かる。故にグルコースには炭素が含まれる。
また、硫酸銅(II)の白色粉末に触れさせると青色に変色したことから、この青色物質が硫酸銅(II)五水和物と推測されるため、生成した液体は水 $\ce{H2O}$。ゆえにグルコースには水素が含まれることが分かる。
なお 二酸化炭素や水の酸素原子は、グルコースに含まれていた酸素なのか、燃焼した際に結合した酸素なのか、酸化銅にあった酸素なのかが不明であるため、グルコースに酸素が含まれているかどうかは、この実験の結果からは分からない。
グルコースの分子式は $\ce{C6H12O6}$ であり燃焼式は次の通り。
$\ce{C6H12O6 + 6O2 -> 6CO2 + 6H2O}$
酸化銅(II)は完全燃焼させるために加えている。
(10-019) ある水溶液に硝酸銀水溶液を加えると白色沈殿が生じた。この実験結果から推測される、水溶液に含まれる元素を次の選択肢から一つ選べ。
① ナトリウム ② 塩素 ③ 酸素 ④ 水素
答えと解説
(答) ② 塩素
(解説) 硝酸銀水溶液には銀イオンが含まれており、これが白色沈殿を作ると考えれば塩化銀が思い浮かぶ。$\ce{Ag+ + Cl- -> AgCl↓}$ は丸暗記してほしい。
かなりマニアックにはなるが、$\ce{Ag+}$ は $\ce{SCN-}$ とも白色沈殿 ($\ce{AgSCN}$)を作るので本問は選択式とした。しかし、高校化学で銀の白色沈殿といったら(フォルハルト法という沈殿滴定を除けば)塩化銀で確定させて良いだろう。
(10-020)次の各物質の状態変化の名称を、それぞれ語群から1つ選んで答えよ。
同じ語句は2度使用してはならない。
(1)固体から液体 (2)液体から気体
(3)気体から固体 (4)固体から気体
(5)気体から液体 (6)液体から固体
語群:
凝縮 凝固 凝華 蒸発 溶解 融解 昇華
答えと解説
(答)
(1)固体から液体・・・融解
(2)液体から気体・・・蒸発
(3)気体から固体・・・凝華
(4)固体から気体・・・昇華
(5)気体から液体・・・凝縮
(6)液体から固体・・・凝固
(解説)
融解は、注目物質そのものが融けること。溶解は水などの溶媒に溶けること。意味が異なるので注意。
旧課程では、「固体から気体」・「気体から固体」ともに「昇華」とよばれていた。
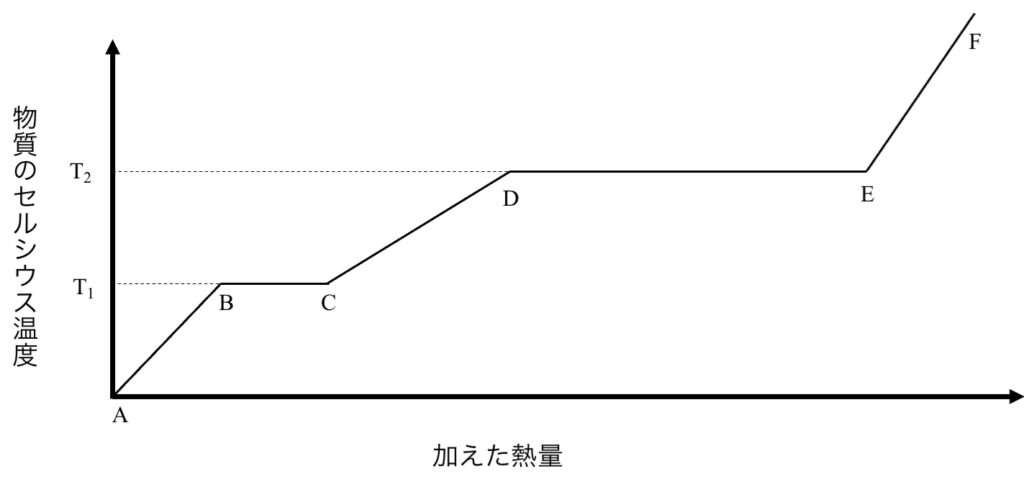
(10-021) 下のグラフは、ある純物質の固体を大気圧下で加熱したときの、物質の温度変化を縦軸、それまでに加えた熱量を横軸に表したものである。
(1)温度 $T_1, T_2$ はそれぞれ何と呼ばれているか。漢字2字でそれぞれ答えよ。
(2)液体と気体が共存している区間はどこか。選択肢から選び記号で一つ答えよ。
ただし気体に関して、蒸発によって生じる気体は無視し、沸騰によって生じるもののみ考慮せよ。
選択肢:① AB間 ② BC間 ③ CD間 ④ DE間 ⑤ EF間
答えと解説
(答)
(1) $T_1$ :融点、 $T_2$:沸点
(2) ④ DE間
(解説)
固体を加熱していくと、次のような順番で物質の状態が変化していく。
AB間:固体の温度が上昇する。
BC間:温度一定で、固体から液体に変化する。(融解)
CD間:液体の温度が上昇する。
DE間:温度一定で、液体から気体に変化する。(沸騰)
EF間:気体の温度が上昇する。
蒸発は液体の表面付近から気体になる現象で、BC間とCD間とDE間で起こっている。沸騰は液体内部からも気体になる現象で、沸点に達すると起こる。よって沸騰はDE間のみで生じている。
(10-022) 次の化学の基本法則を述べた文章について、その法則名と発見者の名前を語群から1つ選べ。
化学反応の前後において、物質の総質量は変わらない。(1774年)
語群: アボガドロ ラボアジエ ヘンリー プルースト ゲーリュサック
答えと解説
(答)
法則名:質量保存の法則
名前:ラボアジエ
(解説)
現代の知識を用いれば、固体の炭酸水素ナトリウム $\pu{84 g}$ を完全燃焼させたとき、モル計算によって
(原子量 $\ce{H}=1, \ce{C}=12, \ce{O}=16, \ce{Na}=23$)
$\ce{2NaHCO3 -> Na2CO3 + H2O + CO2}$
$\pu{1 mol} → \pu{0.50 mol}, \pu{0.50 mol}, \pu{0.50 mol} $
$\pu{84 g} → \pu{53 g} + \pu{9.0 g} + \pu{22 g} $
となり、左辺の質量と右辺の質量の和が $\pu{84 g}$ で等しいことが分かる。
またこの例から、化学反応式の係数比は質量比に等しくないことも分かる。
(10-023) 次の化学の基本法則を述べた文章について、その法則名と発見者の名前を語群から1つ選べ。
ある化合物を構成する成分元素の質量比は、製法に関わらず常に一定である。(1799年)
語群: アボガドロ ラボアジエ ヘンリー プルースト ゲーリュサック
答えと解説
(答)
法則名:定比例の法則 または 一定組成の法則
名前:プルースト
(解説)
呼気に含まれる二酸化炭素 $\ce{CO2}$ も、炭酸水素ナトリウムを燃焼させて生成する二酸化炭素 $\ce{CO2}$ も その成分元素である炭素と酸素の質量比は、
$\ce{C} : (\ce{O} \times 2) = \pu{12 g/mol} : \pu{(16 \times 2) g/mol} = 3:8 $
である。現代からすると炭素原子と酸素原子はいずれも粒子であることから当たり前な法則に見えるが、この法則が発見された当時は粒子か連続体であるかが不明であった。成分元素の質量比が常に一定であることの発見は、炭素や酸素が粒子である可能性を示唆している。
(例えば連続体であれば、炭素成分が多い二酸化炭素や、酸素成分が多い二酸化炭素が作れそうである。カフェオレでもコーヒー成分が多いものや牛乳成分が多いものがあるように、連続体であるものは成分の組成比が一定ではない。)
(10-024) 次の化学の基本法則を述べた文章について、その法則名と発見者の名前を語群から1つ選べ。
A, Bという2つの元素が化合していくつかの化合物をつくる場合,一定質量の元素Aと化合する元素Bに注目すると、それぞれの化合物の元素Bの質量の間には簡単な整数比がなりたつ。(1803年)
語群: アボガドロ ラボアジエ ヘンリー プルースト ゲーリュサック
答えと解説
(答)
法則名 : 倍数比例の法則 または 倍数組成の法則
名前 : ドルトン
例えば、$\ce{NO}, \ce{NO2}, \ce{N2O}$ に含まれる窒素と酸素の質量比を考えると、
原子量 $\ce{N}=14, \ce{O}=16$ 用いて、
$\ce{NO}$について、$14:16=7:8$
$\ce{NO2}$について、$14:32=7:16$
$\ce{N2O}$について、$28:16=7:4$
である。一定量の窒素について化合している各酸素の質量比を確認すると、
$\ce{NO: NO2 : N2O} = 8:16:4=4:8:1$
となり、簡単な整数比となっている。
(10-024) 次の化学の基本法則を述べた文章について、その法則名と発見者の名前を語群から1つ選べ。
同温・同圧のもとにおける気体どうしの反応では、反応に関係する気体の体積の間に簡単な整数比が成り立つ。(1808年)
語群: アボガドロ ラボアジエ ヘンリー プルースト ゲーリュサック
答えと解説
(答)
法則名:気体反応の法則
名前:ゲーリュサック
例えば、水素 $\ce{H2}$ と酸素 $\ce{O2}$ が完全に反応して水蒸気 $\ce{H2O}$ を生成する反応において、各物質の体積を $V_{\ce{H2}}, V_{\ce{O2}}, V_{\ce{H2O}}$ とおくと、同温・同圧において、
$V_{\ce{H2}} : V_{\ce{O2}} : V_{\ce{H2O}} = 2:1:2$
が成立する。ゲーリュサックはこのような法則を実験によって確かめた。
現代の知識では、 $\ce{2H2 + O2 -> 2H2O}$ の係数比から分かる。
ゲーリュサックは発見したこの気体反応の法則の説明を、ドルトンの原子説に基づいて試みた。しかしこれらの間には矛盾点が存在するために、ドルトンは気体反応の法則を認めなかった。
(10-025) 気体反応の法則を前提に原子説を考えた場合、矛盾点が生じる。矛盾点を「水素 + 酸素 → 水蒸気」の化学反応を例に、絵などを用いて説明せよ。また、原子説に関しては下の文章を参考にせよ。
(1) 元素は原子とよばれる小さな粒子でできていてそれ以上分割できない。
(2) ある元素の原子は他の元素の原子とは異なる。異なる元素の原子は相対原子質量によって互いに区別できる。
(3) 同じ元素の原子は、同じ大きさ、質量、性質を持つ。
(4) 化合物は、異なる原子が一定の割合で結合してできる複合原子である。
(5) 化学反応は原子と原子の結合の仕方が変化するだけで、新たに原子が生成したり消滅することはない。
※ ドルトンは「自然界はできるだけ単純である」ということを提唱しており、それによれば現代でいう「単体」は単一の原子からなる。すなわち水素は $\ce{H2}$ ではなく $\ce{H}$ である。
答えと解説
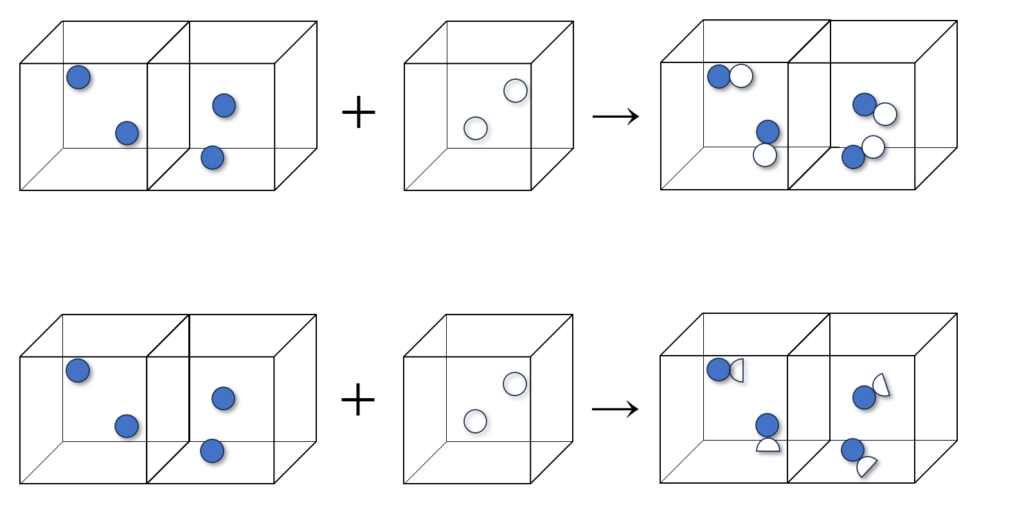
気体反応の法則を前提としているので、反応する体積の比は $2:1:2$ で考える。
青丸は水素、白丸は酸素、青丸と白丸のペアーは水蒸気を表していて、$1$ 体積に $2$ 原子(または $2$ つの複合原子)入っている必要がある。
そのような条件を満たすには上記の図のような化学反応になる。
上の反応図は、左辺の酸素が $2$ 原子であるが右辺の酸素は $4$ 原子あるので原子説の(5)と矛盾。
下の反応図は、両辺とも酸素が $2$ 原子であるが、原子が半分に割れているので原子説の(1)と矛盾。
ゆえに気体反応の法則をドルトンの原子説を用いて説明することができない。
(10-026) 次の文章のうち、「酸素」が単体の意味で使われているものを記号で一つ答えよ。
(1) 水分子は水素と酸素から構成される。
(2) 酸素には主に $3$ 種類の同位体が存在する。
(3) 水を電気分解すると酸素が得られる。
(4) 人体には約$60$%の酸素が含まれる。
答えと解説
(答)(3)
(解説)
「酸素」の単体は化学式で書くと $\ce{O2}$ で、気体の物質である。
(1) この文章は 「$\ce{H2O}$ が水素という元素と酸素という元素で構成されている」という文章なので、気体としての $\ce{O2}$ を指しているわけではない。単体ではなく、元素の意味で述べられている。
「元素か、単体か?」といった出題もある。そういった問題を解くにあたっては、「元素は構成成分を指す」と考えて良い。
(2) 酸素には、$\ce{^16O, ^17O, ^18O}$ の $3$ 種類の同位体が存在する。
この酸素も気体物質としての酸素を指しているわけではなく、原子として述べられている。
(3) 水を電気分解すると、気体の酸素 $\ce{O2}$ と気体の水素 $\ce{H2}$ が生成する。この酸素は気体物質としての酸素であるから、単体として述べられている。
(4) これが単体の意味としての酸素であれば、人体の約 $60$ %が気体の $\ce{O2}$ という意味になるので、これだとヤバい人間のできあがりである。THE ・ 気体人間。
そうではなく、人体の体重の半分ほどが水で占められていることから、この酸素は水 $\ce{H2O}$ の $\ce{O}$ を指していると考えられる。すなわち元素の意味で用いられている。
他の問題では以下のような文章で出題されることがある。
(5) 骨にはカルシウムが含まれている。
単体だと $\ce{Ca}$ 。金属の固体である。一方、 骨に含まれるカルシウムは「リン酸カルシウム $\ce{Ca3(PO4)2}$」。よって構成成分を指すので、元素として述べられている。
(6) 血液には鉄が含まれている。
単体だと、$\ce{Fe}$ 。固体の金属の鉄を思い浮かべれば良い。一方、血液中の鉄は他の物質と結合して存在するため、構成成分を指すと考える。したがって元素として述べられている。
著者の愚痴
私はこの問題が大嫌いである。元素か原子か単体かというのは、深く考えると結構難しい。というか「元素」というのが定義でバチッと決まっているものなのだろうか。Wikipedia によると、
現代では、「原子」が《物質を構成する具体的要素》を指すのに対し「元素」は《性質を包括する抽象的概念》を示す用語となった。化学の分野では、化学物質を構成する基礎的な成分(要素)を指す概念を指し、これは特に「化学元素」と呼ばれる。化学物質を構成する基礎的な要素と「万物の根源をなす究極的要素」としての元素とは異なるが、自然科学における元素に言及している文献では、混同や説明不足も見られる
https://ja.wikipedia.org/wiki/%E5%85%83%E7%B4%A0
偉いヒトが混同しているのだから、現代の初学者が混同しないわけがない。
入試においてはだんだん出題頻度は減っているが、無くなってはいないので一応紹介した。
この問題は絶滅してほしい。




