第2問 | 概評と答え
理論化学と無機化学の総合問題。
I は$\,\ce{Fe}\,$系統の色の定番問題と結晶。「イオンが隙間を占有」という問題文の言い回しに慣れていない人は難しく感じたかもしれないです。熱化学方程式も融合しています。全体としては標準的。
II はハロゲンを中心とした問題。知識問題もあるが問題文をヒントに考えるものもあります。全体としては易しめ。
第2問では$\, 7\,$割~$\, 8\,$割欲しいです。
| I | ||
| 問1 | (ア) (え) (イ) (き) (ウ) ステンレス (エ) テルミット | |
| 問2 | 六方最密構造 : $2$ 面心立方格子 : $4$ | |
| 問3 | (オ)$ \pu{0.21 nm}$ (カ) $\pu{0.18 nm}$ | |
| 問4 | (1) | (a) $3$ (b) $2$ (c) $3$ |
| (2) | $\ce{Fe}$ : $\pu{80 kg}$ $\ce{CO2}$ : $\pu{83 kg}$ | |
| 問5 | $\ce{2Al (固) + Fe2O3 (固) = Al2O3 (固) + 2Fe (固) + 852 kJ}$ | |
| II | ||
| 問1 | $45$ | |
| 問2 | (け) | |
| 問3 | 単体$\,\rm{A}$: $\ce{H2}$ 化合物$\,\rm{B}$: $\ce{NaOH}$ | |
| 問4 | $\ce{Cl2}$ | |
| 問5 | $\ce{Cl2O7 + H2O -> 2HClO4}$ | |
| 問6 | 陽イオン : $\ce{H3O+}$ 陰イオン : $\ce{ClO4 ^{-}}$ | |
| 問7 | $\ce{IO3 ^- + 6H+ + 6e- -> I- + 3H2O}$ |
I 鉄の総合問題
問1
(ア)(イ)
$\,\ce{Fe^{2+}}\,$や$\,\ce{Fe^{3+}}\,$の検出反応は定番問題。確実に答えておきたいです。
| $\ce{OH-}$ | $\ce{K4[Fe(CN)6] aq}$ | $\ce{K3[Fe(CN)6] aq}$ | $\ce{KSCN aq}$ | |
|---|---|---|---|---|
| $\ce{Fe^{2+} aq}$ 淡緑色 | $\ce{Fe(OH)2}$ 緑白色沈殿 | ( 暗記不要 ) | 濃青色沈殿 | 反応しない |
| $\ce{Fe^{3+} aq}$ 黄〜黄褐色 | $\ce{Fe(OH)3}$ 赤褐色沈殿 | 濃青色沈殿 | ( 暗記不要 ) | 血赤色溶液 |
(ウ)
鉄にクロムやニッケルなどを添加して腐食を抑制した合金はステンレス鋼とよばれます。
(エ)
$\,\ce{Al}\,$の粉末と$\,\ce{Fe2O3}\,$の反応は多量の熱が発生し、融解された$\,\ce{Fe}\,$が生成します。
これをテルミット反応といい、レールの溶接などに用いられます。
問2 単位格子内の粒子の数
問題文が長いですが、結局は単位格子に含まれる粒子の数を答えるだけの超基本問題です。
問3 スピネル構造をもつ結晶格子内の粒子間の距離
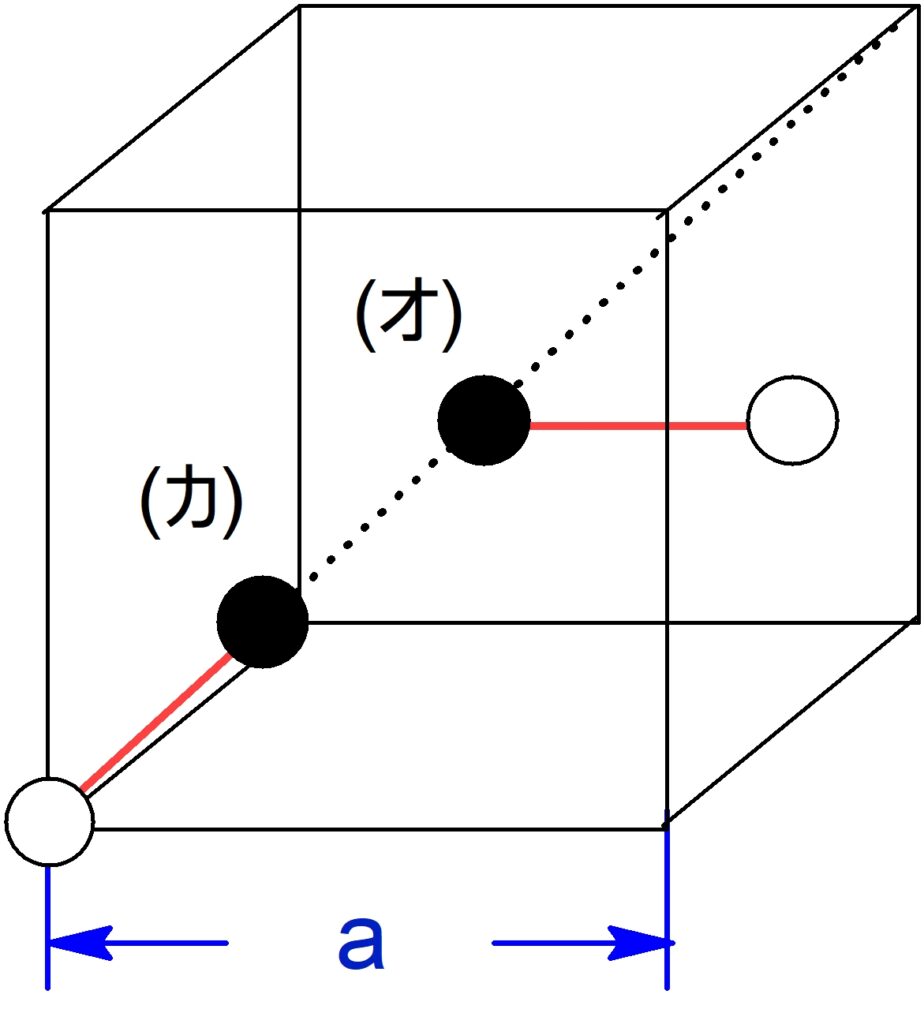
また (カ)と図の左下の白の原子の長さは、体対角線の $\f{1}{4}$ であることにより、$\f{\sqrt{3}}{4}a$となる。
(オ) の$\,\ce{Fe}\,$イオンと最も近い$\,\ce{O^{2-}}\,$は立方体の面の中心に位置します。
それらの距離は単位格子の半分の長さです。$$\pu{0.42 nm} \times \f{1}{2} = \bold{\pu{0.21 nm}}$$
(カ) の$\,\ce{Fe}\,$イオンと最も近い$\,\ce{O^{2-}}\,$は立方体の頂点に位置します。
また(カ) の$\,\ce{Fe}\,$イオンは、立方体を$\, 8\, $等分した小立方体の中心に存在します。
求める距離は小立方体の体対角線の半分の長さです。(上図の説明の文章も参考にしてください。)$$\pu{\f{\sqrt{3}}{4} \times 0.42 nm} \fallingdotseq \bold{\pu{0.18 nm}}$$
問4 酸化鉄の還元と計算
(1)
係数は登場回数が多い原子を後回しにして考えれば良いです。この式では$\,\ce{O}\,$は後回しにします。
まずは$\,\ce{Fe}\,$の数を合わせて、
$$\ce{Fe2O3 + (a)CO -> \color{red}{2}Fe + (c)CO2}$$
炭素の数に注目すると (a) と (c) は同じ数なので、1, 2, 3 … と代入していって$\,\ce{O}\,$の数を合わせます。
$$\ce{Fe2O3 + \color{red}{3}CO -> 2Fe + \color{red}{3}CO2}$$
他にも問題文中の (1)~(3) 式から作ったり、未定係数法で決めたりできますが、このやり方が一番早いです。
(2)
$$\ce{Fe2O3 + 3CO -> 2Fe + 3CO2}$$
反応式の係数比は $\ce{Fe2O3} : \ce{Fe} = 1 : 2$、$\ce{Fe2O3} : \ce{CO2} = 1 : 3$
モル質量 $\ce{Fe2O3} = 160, \, \ce{Fe} = 56,\, \ce{CO2} = 44$ を用いて、
$\,\ce{Fe}\,$は$$\f{\pu{100 kg}}{\pu{160 g/mol}} \times 2 \times \pu{56 g/mol} = \pu{80 kg} $$
$\,\ce{CO2}\,$は$$\f{\pu{100 kg}}{\pu{160 g/mol}} \times 3 \times \pu{44 g/mol} = \pu{82.5 kg} $$
問5 熱化学方程式
$$\ce{2Al + Fe2O3 = Al2O3 + 2Fe + \pu{Q kJ}} $$ において、
公式: (反応熱) = (生成物の生成熱の総和) – (反応物の生成熱の総和) を使います。
(筆者は数値代入法を使っていますが、より一般的に使われている方で解説します。)
単体の生成熱が$\,\pu{0 kJ/mol}\,$ であることに注意して
$$\begin{align}
Q &= ( 1676 + 2 \times 0 ) – (2 \times 824 + 0 )\\
\\
&= 852
\end{align}$$答える熱化学方程式は、
※ 熱化学方程式内は「$\ce{->}$」ではなく「=」で結び、熱量の単位は 「$\pu{kJ/mol}$」ではなく「$\pu{kJ}$」とすること。
II ハロゲンの総合問題
問1 Br の中性子数
問題文中に「周期表の臭素の位置と文章から推定」とあるのでそれに従います。
ハロゲンは周期表で上から順番に$\,\ce{F -> Cl -> Br -> I}\,$です。
$\,\ce{F}\,$の原子番号は$\, 9\, $、$\ce{Cl}$ は$\,17\,$。その下の$\,\ce{Br}\,$ の原子番号は$\,18\,$を足して$\,35\,$ と分かります。
さらに文章中に臭素の分子量が$\,160\,$とあるので、$\,\ce{Br2} = 160\,$から原子量は$\,\ce{Br} = 80\,$です。
( 原子量 ) $=$ ( 同位体の各相対質量の平均 ) $\fallingdotseq$ ( 同位体の各質量数の平均 ) の関係があります。
$\,\ce{_{35}^{80}Br}\,$ と書けることから、原子$\,1\,$ 個あたり中性子数の平均値は$\,80-35= \bold{45}\,$ と答えられます。
問2 ・問3 陽イオン交換膜法の基本
塩化ナトリウム水溶液を電気分解すると、 (キ) 陽極で$\,\ce{Cl2}\,$が生成します。$$\ce{2Cl- -> Cl2 ^ + 2e- }$$ 陽極と (ク) 陽イオン交換膜で仕切られた (ケ) 陰極では単体$\,\rm{A}\,(\bold{\,\ce{H2}})\,$が生じて化合物$\,\rm{B}\,(\bold{\,\ce{NaOH}}\,$)の水溶液が得られます。 $$\ce{H2O + 2e- -> H2 ^ + 2OH-}$$
問4
$\,\ce{Br}\,$より強い酸化剤は$\,\ce{F, Cl}\,$。単体である$\,\ce{F2}\,$ガスは反応性が高く扱いが難しいため、答えとしては$\,\bold{\ce{Cl2}}\,$が適当です。
問5
一度経験していないと書くのは厳しいかもしれません。$\,\ce{Cl2O7}\,$は非金属酸化物なので水と反応するときは酸性酸化物としてふるまいます。ここに気づけば、オキソ酸が出てくるだろうと予測ができます。
例えば三酸化硫黄の例で言えば、$$\ce{SO3 + H2O -> H2SO4}$$と同じような反応です。機械的に$\,\ce{Cl2O7}\,$と$\,\ce{H2O}\,$を足し合わせて$\,\ce{H2Cl2O8}\,$とし、原子の個数を等分すれば容易に作れます。 $$\ce{Cl2O7 + H2O -> 2HClO4}$$
問6
文中の「過塩素酸一水和物」をそのまま式で表すと$\,\ce{HClO4.H2O}\,$と書けます。ただしこの後の文章で「過塩素酸オキソニウムと呼ぶほうが実際の構造をよく表している。」とあります。先程の式の中で$\,\ce{H+}\,$を移動させて、$\,\ce{ClO4- .H3O+}\,$と書けることが分かります。
問7
電子$\,\ce{e-}\,$を含むイオン反応式とあるので、これは酸化還元反応の半反応式を書けば良いことが分かります。
$$\ce{IO3^- -> I-}$$酸素$\,\ce{O}\,$の数を$\,\ce{H2O}\,$で合わせて$$\ce{IO3^- -> I- + 3H2O}$$ 水素$\,\ce{H}\,$の数を$\,\ce{H+}\,$で合わせて $$\ce{IO3^- + 6H+ -> I- + 3H2O}$$ 電荷を$\,\ce{e-}\,$で合わせて $$\ce{IO3^- + 6H+ + 6e- -> I- + 3H2O}$$



